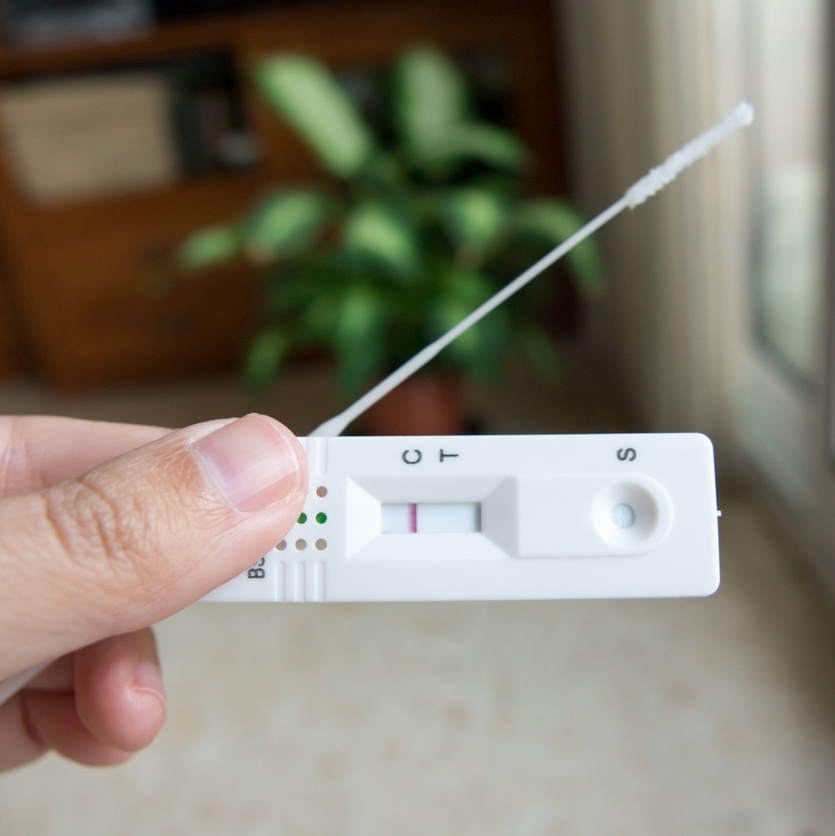
A Agência Nacional de Vigilância Sanitária (Anvisa) decidiu, hoje, que vai liberar a venda de autotestes de Covid-19 no Brasil. A decisão não tem efeito imediato: cada empresa interessada em comercializar sua versão do produto precisa pedir o registro junto à agência, que vai analisar cada solicitação. A Anvisa informou que espera ter os primeiros produtos aprovados em fevereiro. As informações são do portal G1.
Reprodução
Resumo da decisão em 5 pontos:
- Anvisa liberou a venda de autotestes, mas empresas precisam pedir registro antes da comercialização em farmácias ou estabelecimentos da área de saúde;
- Resultado positivo não será considerado como caso confirmado de Covid-19;
- Empresas podem – voluntariamente – criar sistemas com QRCode para registro dos resultados;
- Autoteste servirá como triagem: Ministério disse à Anvisa que vai orientar busca por atendimento médico para quem testou positivo;
- Resultado do autoteste não servirá para apresentação para viagens ou atestado médico.
A medida vale apenas para os testes de antígenos (feito a partir do swab que coleta o material no fundo da boca e do nariz e busca sinais de anticorpos gerados após a infecção), e não se aplica ao teste RT-PCR (mais preciso, mais demorado e que detecta a presença do material genético do coronavírus).
De acordo com os diretores da Anvisa, ficou definido que o Ministério da Saúde vai incluir orientações sobre o uso dos autotestes em uma atualização do “Plano Nacional de Expansão de Testagem para Covid-19” (PNE Teste).
Além disso, sem impor como condição, a Anvisa espera que as empresas desenvolvam estratégias para que – voluntariamente – os compradores dos autotestes informem os resultados por meio de sistema na internet.
A Anvisa aceitou a argumentação do Ministério da Saúde de que é preciso diferenciar o “registro do resultado de um autoteste” e a “notificação de um caso de Covid-19”.
“A partir do resultado positivo, procure uma unidade de atendimento de saúde (ou tele atendimento) para que um profissional de saúde realize a confirmação do diagnóstico, notificação e orientações pertinentes”, afirmou a relatora Cristiane Rose Jourdan Gomes, citando o ministério da Saúde.

















Poste seu comentário